Síndrome del músculo piramidal: tratamiento mediante infiltración con guía tomográfica
Piriformis syndrome: Treatment by infiltration with tomographic guidance
- MARTIN RAVAGNA - Autor principal (HOSPITAL GENERAL DE AGUDOS JUAN A. FERNANDEZ)
- ANA LAURA DOUGLAS PRICE
- JULIAN ROMAGNOLI
- LUIS ADROGUÉ
- MARIANO GITARD
- ALDANA OTTAVIANI
- HORACIO BAUSSET
- LUIS KENIGSBERG
Autor para correspondencia:
MARTIN RAVAGNA
HOSPITAL GENERAL DE AGUDOS JUAN A. FERNANDEZ
email: martinravagna@hotmail.com
MARTIN RAVAGNA
HOSPITAL GENERAL DE AGUDOS JUAN A. FERNANDEZ
email: martinravagna@hotmail.com
Resumen
Objetivo: El síndrome del músculo piramidal (SP) es un conjunto de síntomas, dolor, lumbar o glúteo, irradiado al miembro inferior, debido a la compresión del nervio ciático producida por el músculo piramidal (MP). El objetivo de nuestro estudio es evaluar pacientes con diagnóstico clínico de SP a los cuales se les practicaron infiltraciones con anestésicos locales y esteroides, bajo guía tomográfica, tras el fracaso del tratamiento conservador.
Material y metodología: tratamos diez pacientes mediante infiltraciones con anestésicos locales y esteroides, bajo guía tomográfica. Todos presentaban diagnóstico clínico de SP refractario al tratamiento conservador. Siete fueron mujeres y el promedio de edad fue de 51 (32-82) años. Al momento del diagnóstico, los pacientes habían manifestado el cuadro clínico por 35 (6-72) meses de promedio. Se realizó un seguimiento promedio de 9 (0-17) meses. Se evaluó antes y después de la infiltración con la escala visual analógica para evaluar el dolor.
Resultados: Se encontró mejoría significativa después de la infiltración y ninguno de los pacientes presentó complicaciones inherentes al procedimiento.
Conclusión: la infiltración con anestésicos locales y esteroides bajo guía tomográfica, mejora significativamente a los pacientes con SP, con la ventaja de poder visualizar el sitio exacto a infiltrar, evitando lesionar estructuras neuro-vasculares.
Material y metodología: tratamos diez pacientes mediante infiltraciones con anestésicos locales y esteroides, bajo guía tomográfica. Todos presentaban diagnóstico clínico de SP refractario al tratamiento conservador. Siete fueron mujeres y el promedio de edad fue de 51 (32-82) años. Al momento del diagnóstico, los pacientes habían manifestado el cuadro clínico por 35 (6-72) meses de promedio. Se realizó un seguimiento promedio de 9 (0-17) meses. Se evaluó antes y después de la infiltración con la escala visual analógica para evaluar el dolor.
Resultados: Se encontró mejoría significativa después de la infiltración y ninguno de los pacientes presentó complicaciones inherentes al procedimiento.
Conclusión: la infiltración con anestésicos locales y esteroides bajo guía tomográfica, mejora significativamente a los pacientes con SP, con la ventaja de poder visualizar el sitio exacto a infiltrar, evitando lesionar estructuras neuro-vasculares.
Abstract
Objective: Piriformis Syndrome (SP) is a set of symptoms that includes pain, in the lumbar or gluteal region, radiating to the lower limb, caused by compression of the sciatic nerve by the piriformis muscle (MP). The diagnosis is clinical, and is usually exclusionary. Our purpose is to evaluate patients with clinical diagnosis of PS who underwent infiltrations with local anesthetics and steroids, under tomographic guidance, after the failure of conservative treatment.
Material and method: Ten patients, seven female, were treated by infiltrations with local anesthetics and steroids, under tomographic guidance. All had a clinical diagnosis of PS refractory to conservative treatment. The average age was 51 (32-82) years. At the time of diagnosis, patients had manifested the clinical picture for 35 (6-72) months on average. An average follow-up of 9 (0-17) months was carried out.
Results: infiltration with local anesthetics and steroids with tomographic guidance was performed in 10 patients with a clinical diagnosis of PS. Symptomatic improvement was evaluated through the VAS. Significant differences are observed, decreasing the score between the two shots by almost 6 points. None of the patients studied presented complications inherent in the procedure.
Conclusion: infiltration with local anesthetics and steroids under tomographic guidance as part of the PS treatment allows us to obtain a statistically significant symptomatic improvement, with the advantage of being able to visualize the exact site to be infiltrated, avoiding injury to neurovascular structures.
Material and method: Ten patients, seven female, were treated by infiltrations with local anesthetics and steroids, under tomographic guidance. All had a clinical diagnosis of PS refractory to conservative treatment. The average age was 51 (32-82) years. At the time of diagnosis, patients had manifested the clinical picture for 35 (6-72) months on average. An average follow-up of 9 (0-17) months was carried out.
Results: infiltration with local anesthetics and steroids with tomographic guidance was performed in 10 patients with a clinical diagnosis of PS. Symptomatic improvement was evaluated through the VAS. Significant differences are observed, decreasing the score between the two shots by almost 6 points. None of the patients studied presented complications inherent in the procedure.
Conclusion: infiltration with local anesthetics and steroids under tomographic guidance as part of the PS treatment allows us to obtain a statistically significant symptomatic improvement, with the advantage of being able to visualize the exact site to be infiltrated, avoiding injury to neurovascular structures.
: Síndrome del Piramidal, dolor lumbar, musculo piramidal, guía tomográfica
: Pyramidal syndrome, lumbar pain, pyramidal muscle, tomographic guide
Introducción
El síndrome del músculo piramidal (SP) es un conjunto de síntomas que incluye dolor en la región lumbar o glútea, irradiado al miembro inferior, causado por la compresión del nervio ciático por el músculo piramidal (MP) [1]. El diagnóstico de SP es clínico y considerado como un diagnóstico de exclusión. Otras causas de dolor en la región glútea con irradiación ciática, como son la enfermedad degenerativa lumbar (radiculopatía, artropatía facetaría, discopatía), alteraciones de la articulación sacro-ilíaca, quistes y tumores, intra o extrapélvicos, bursitis trocantérica, endometriosis, fibrosis, aneurismas o pseudoaneurismas y malformaciones arterio-venosas [2-4].
Robinson [1] acuñó el término y concepto de SP al reconocer que la ciatalgia era un síntoma y no una patología, ya que raramente es causada por una patología intrínseca del nervio ciático. Consideró que el término SP se debe aplicar a la ciatalgia causada por una condición anormal del MP, asociado, generalmente, a un antecedente traumático.
Pace y Nagle [5] señalaron una incidencia del 6% en un estudio sobre dolor lumbar, con una relación mujer / hombre de 6:1. Bernard y Kirkaldy-Willis [6], en 1.293 pacientes con dolor lumbar, encontraron un 0,33% de casos de SP. Parziale et al., [7] describieron una incidencia del 5% de SP, entre pacientes con dolor lumbar y ciatalgia y según Fishman yet al., [8] el SP es el responsable del 6% - 8% de los casos anuales de dolor lumbar con irradiación ciática en Estados Unidos.
El SP es más frecuente entre los 30 y los 40 años de edad, siendo infrecuente en pacientes menores de 20 años [10]. El paciente tipo con un SP, se presenta con dolor glúteo, con o sin irradiación a la cara posterior del muslo ipsilateral, que en ocasiones se extiende por debajo de la rodilla, recordando un cuadro de ciatalgia [10]. El dolor en la región glútea o la ciatalgia pueden ser exacerbados por la flexión, la aducción o la rotación interna de la articulación de la cadera, ya que elongan el músculo piramidal. Sin embargo, la característica distintiva del SP es la intolerancia a la sedestación [9]. De hecho, Benson y Schutzer [11] encontraron intolerancia a la sedestación en los 14 pacientes que trataron quirúrgicamente mediante tenotomía del MP y neurolisis del nervio ciático, obteniendo un alivio inmediato y duradero de la sintomatología.
Debido a la proximidad el MP con la pared pelviana, los pacientes pueden quejarse de dispaurenia o dolores miccionales [12].
El dolor puede ceder con la tracción [13] o rotación externa de la extremidad [9]. Suele existir una historia previa de dolor glúteo con o sin irradiación al muslo posterior. El dolor suele exacerbarse con la actividad exacerbada de los músculos rotadores de la cadera, la sedestación prolongada sobre superficies duras o la marcha. La existencia de un antecedente de traumatismo cerrado en la región glútea es altamente sugestivo. En ocasiones la presentación del cuadro doloroso es espontáneo. El embarazo también es un factor de riesgo para la aparición del SP [12].
El paciente puede presentar marcha antiálgica, con un miembro inferior acortado y en rotación externa cuando se encuentra en posición supina [14].
Al examen físico, suele haber dolor palpatorio en la región glútea, sobre todo sobre el MP, pudiendo haber un punto gatillo, generalmente en la intersección del MP con el nervio ciático, el cual a la compresión desencadena dolor irradiado en territorio ciático. También se pueden apreciar una masa alargada, blanda a la palpación, sobre el MP, atrofia glútea y un signo de Lasegue positivo [1]. La atrofia glútea puede derivar en un signo de Trendelemburg positivo, siendo la compresión de los nervios glúteos una posible explicación [13].
La evaluación neuromuscular debe ser llevada a cabo minuciosamente. Si se detecta algún tipo de déficit sensitivo o motor [15], el diagnóstico de SP se torna menos probable, excepto en casos crónicos donde la atrofia por desuso suele estar presente.
Existen varias maniobras diagnosticas cuya sensibilidad y especificidad no han sido determinadas [16] que se basan en la contracción activa contra resistencia del MP así como en su estiramiento pasivo. La maniobra de Freiberg consiste en la rotación interna forzada del miembro, mientras el paciente está en decúbito supino, en un intento de estirar el MP irritado y provocar la compresión del nervio ciático [3]. Pecina [17], en 130 especímenes cadavéricos, demostró que en la rotación interna pasiva de la cadera, el MP comprimía el nervio peroneo común en el 20,77 % de los casos en los cuales los atravesaba, mientras que con la rotación externa la compresión desparecía.
Los estudios electrofisiológicos han determinado que la compresión máxima del ciático se obtiene con la cadera en flexión, aducción y rotación interna, es el FADIR test (Flexión, Aducción y Rotación Interna) [18].
La maniobra de Pace [5], una contracción activa contra resistencia, desencadena el dolor al abducir la cadera desde la sedestación, al generar la contracción del MP. Beatty [3] propone otra prueba con el paciente en decúbito lateral, con el lado afectado sobre la camilla, con flexión de la cadera y la rodilla. La abducción de la cadera desencadena dolor glúteo en aquellos con SP, mientras que en aquellos con enfermedad discal lumbar se desencadena dolor lumbar irradiado a territorio ciático.
El MP está inervado por las ramas anteriores de las raíces S1 y S2, las cuales se unen para formar el nervio del piramidal, rama directa del nervio ciático [11][19], pero está íntimamente relacionado con el nervio ciático, presentando numerosas variaciones anatómicas [20].
El mecanismo fisiopatológico es incierto y se defienden, sobre todo, tres teorías, donde finalmente un MP espástico, hipertrófico o inflamado, comprime el nervio ciático contra elementos óseos [7][8][21]. Robinson [1] atribuye el cuadro al atrapamiento del nervio ciático por adherencias del MP causadas por un traumatismo inicial, constituyendo un síndrome de atrapamiento nervioso. Pecina [3] lo achaca a una variación anatómica por la cual el nervio ciático atraviesa la porción tendinosa del MP, comprimiéndolo con los movimientos de flexión y rotación interna de la cadera, desencadenando el daño nervioso y por ende, el cuadro clínico [17]. Para Pace y Nagle [5], la irritación del MP está ocasionada por un traumatismo cerrado, resultando un síndrome de dolor miofascial.
El método diagnóstico más sensible es la Resonancia Magnética (RM) que puede identificar alteraciones anatómicas que producen la compresión de las raíces lumbosacras o del nervio ciático [22]. La Tomografía Computada (TC), la ecografía y el centellograma óseo son más útiles para excluir otras causas.
El EMG suele ser normal. Sin embargo, en compresiones de larga evolución, actividad anormal espontánea puede observarse en músculos inervados por el nervio ciático, en particular por su rama peronea común [23]. La mayoría de los autores creen que la compresión del nervio ciático por parte del MP siempre debería ser confirmada por estudios de conducción nerviosa antes de llevar a cabo el tratamiento quirúrgico, en caso de SP refractario al tratamiento incruento [11][12][15][24].
El tratamiento conservador suele ser suficiente en la mayoría de los casos. Se administran antiinflamatorios no esteroideos, relajantes musculares y drogas para el tratamiento del dolor neuropático, como la pregabalina o la gabapentina. También se inicia fisio-kinesioterapia. El pilar del tratamiento es la elongación del MP [25][26]. La elongación del MP puede practicarse en bipedestación o decúbito supino, llevando la cadera a la posición FADIR. Este ejercicio de elongación, en un principio no es bien tolerado por los pacientes, ya que suele desencadenar el dolor. Luego de conseguida la elongación, se llevan a cabo ejercicios de estabilización lumbosacra y fortalecimiento de la musculatura de la cadera [16].
Los pacientes que no mejoran con el tratamiento conservador son candidatos a métodos terapéuticos más agresivos, como lo son las inyecciones de anestésicos locales y esteroides, las cuales son útiles ya que a través del éxito terapéutico también reconfirman el diagnóstico y permiten realizar una rehabilitación menos dolorosa [1][5][16][21][27]. Fishman et al., [16] propusieron su protocolo de tratamiento. Una vez hecho el diagnostico, inyectan 1,5 ml de lidocaína 2% y 20 mg de acetónido de triamcinolona, con una aguja espinal de 23 - 25 G. Los pacientes fueron infiltrados utilizando reparos anatómicos y el punto de mayor dolor. Luego fueron sometidos a fisio-kinesioterapia, obteniendo una mejoría del 71,7%, a los cuatro años. La respuesta a las inyecciones puede ser inmediata, pero suele ser de corta duración.
El objetivo de nuestro trabajo es evaluar pacientes con diagnóstico clínico de SP a los cuales se les practicaron infiltraciones con anestésicos locales y esteroides, bajo guía tomográfica, siempre después de haber fracasado el tratamiento conservador.
Robinson [1] acuñó el término y concepto de SP al reconocer que la ciatalgia era un síntoma y no una patología, ya que raramente es causada por una patología intrínseca del nervio ciático. Consideró que el término SP se debe aplicar a la ciatalgia causada por una condición anormal del MP, asociado, generalmente, a un antecedente traumático.
Pace y Nagle [5] señalaron una incidencia del 6% en un estudio sobre dolor lumbar, con una relación mujer / hombre de 6:1. Bernard y Kirkaldy-Willis [6], en 1.293 pacientes con dolor lumbar, encontraron un 0,33% de casos de SP. Parziale et al., [7] describieron una incidencia del 5% de SP, entre pacientes con dolor lumbar y ciatalgia y según Fishman yet al., [8] el SP es el responsable del 6% - 8% de los casos anuales de dolor lumbar con irradiación ciática en Estados Unidos.
El SP es más frecuente entre los 30 y los 40 años de edad, siendo infrecuente en pacientes menores de 20 años [10]. El paciente tipo con un SP, se presenta con dolor glúteo, con o sin irradiación a la cara posterior del muslo ipsilateral, que en ocasiones se extiende por debajo de la rodilla, recordando un cuadro de ciatalgia [10]. El dolor en la región glútea o la ciatalgia pueden ser exacerbados por la flexión, la aducción o la rotación interna de la articulación de la cadera, ya que elongan el músculo piramidal. Sin embargo, la característica distintiva del SP es la intolerancia a la sedestación [9]. De hecho, Benson y Schutzer [11] encontraron intolerancia a la sedestación en los 14 pacientes que trataron quirúrgicamente mediante tenotomía del MP y neurolisis del nervio ciático, obteniendo un alivio inmediato y duradero de la sintomatología.
Debido a la proximidad el MP con la pared pelviana, los pacientes pueden quejarse de dispaurenia o dolores miccionales [12].
El dolor puede ceder con la tracción [13] o rotación externa de la extremidad [9]. Suele existir una historia previa de dolor glúteo con o sin irradiación al muslo posterior. El dolor suele exacerbarse con la actividad exacerbada de los músculos rotadores de la cadera, la sedestación prolongada sobre superficies duras o la marcha. La existencia de un antecedente de traumatismo cerrado en la región glútea es altamente sugestivo. En ocasiones la presentación del cuadro doloroso es espontáneo. El embarazo también es un factor de riesgo para la aparición del SP [12].
El paciente puede presentar marcha antiálgica, con un miembro inferior acortado y en rotación externa cuando se encuentra en posición supina [14].
Al examen físico, suele haber dolor palpatorio en la región glútea, sobre todo sobre el MP, pudiendo haber un punto gatillo, generalmente en la intersección del MP con el nervio ciático, el cual a la compresión desencadena dolor irradiado en territorio ciático. También se pueden apreciar una masa alargada, blanda a la palpación, sobre el MP, atrofia glútea y un signo de Lasegue positivo [1]. La atrofia glútea puede derivar en un signo de Trendelemburg positivo, siendo la compresión de los nervios glúteos una posible explicación [13].
La evaluación neuromuscular debe ser llevada a cabo minuciosamente. Si se detecta algún tipo de déficit sensitivo o motor [15], el diagnóstico de SP se torna menos probable, excepto en casos crónicos donde la atrofia por desuso suele estar presente.
Existen varias maniobras diagnosticas cuya sensibilidad y especificidad no han sido determinadas [16] que se basan en la contracción activa contra resistencia del MP así como en su estiramiento pasivo. La maniobra de Freiberg consiste en la rotación interna forzada del miembro, mientras el paciente está en decúbito supino, en un intento de estirar el MP irritado y provocar la compresión del nervio ciático [3]. Pecina [17], en 130 especímenes cadavéricos, demostró que en la rotación interna pasiva de la cadera, el MP comprimía el nervio peroneo común en el 20,77 % de los casos en los cuales los atravesaba, mientras que con la rotación externa la compresión desparecía.
Los estudios electrofisiológicos han determinado que la compresión máxima del ciático se obtiene con la cadera en flexión, aducción y rotación interna, es el FADIR test (Flexión, Aducción y Rotación Interna) [18].
La maniobra de Pace [5], una contracción activa contra resistencia, desencadena el dolor al abducir la cadera desde la sedestación, al generar la contracción del MP. Beatty [3] propone otra prueba con el paciente en decúbito lateral, con el lado afectado sobre la camilla, con flexión de la cadera y la rodilla. La abducción de la cadera desencadena dolor glúteo en aquellos con SP, mientras que en aquellos con enfermedad discal lumbar se desencadena dolor lumbar irradiado a territorio ciático.
El MP está inervado por las ramas anteriores de las raíces S1 y S2, las cuales se unen para formar el nervio del piramidal, rama directa del nervio ciático [11][19], pero está íntimamente relacionado con el nervio ciático, presentando numerosas variaciones anatómicas [20].
El mecanismo fisiopatológico es incierto y se defienden, sobre todo, tres teorías, donde finalmente un MP espástico, hipertrófico o inflamado, comprime el nervio ciático contra elementos óseos [7][8][21]. Robinson [1] atribuye el cuadro al atrapamiento del nervio ciático por adherencias del MP causadas por un traumatismo inicial, constituyendo un síndrome de atrapamiento nervioso. Pecina [3] lo achaca a una variación anatómica por la cual el nervio ciático atraviesa la porción tendinosa del MP, comprimiéndolo con los movimientos de flexión y rotación interna de la cadera, desencadenando el daño nervioso y por ende, el cuadro clínico [17]. Para Pace y Nagle [5], la irritación del MP está ocasionada por un traumatismo cerrado, resultando un síndrome de dolor miofascial.
El método diagnóstico más sensible es la Resonancia Magnética (RM) que puede identificar alteraciones anatómicas que producen la compresión de las raíces lumbosacras o del nervio ciático [22]. La Tomografía Computada (TC), la ecografía y el centellograma óseo son más útiles para excluir otras causas.
El EMG suele ser normal. Sin embargo, en compresiones de larga evolución, actividad anormal espontánea puede observarse en músculos inervados por el nervio ciático, en particular por su rama peronea común [23]. La mayoría de los autores creen que la compresión del nervio ciático por parte del MP siempre debería ser confirmada por estudios de conducción nerviosa antes de llevar a cabo el tratamiento quirúrgico, en caso de SP refractario al tratamiento incruento [11][12][15][24].
El tratamiento conservador suele ser suficiente en la mayoría de los casos. Se administran antiinflamatorios no esteroideos, relajantes musculares y drogas para el tratamiento del dolor neuropático, como la pregabalina o la gabapentina. También se inicia fisio-kinesioterapia. El pilar del tratamiento es la elongación del MP [25][26]. La elongación del MP puede practicarse en bipedestación o decúbito supino, llevando la cadera a la posición FADIR. Este ejercicio de elongación, en un principio no es bien tolerado por los pacientes, ya que suele desencadenar el dolor. Luego de conseguida la elongación, se llevan a cabo ejercicios de estabilización lumbosacra y fortalecimiento de la musculatura de la cadera [16].
Los pacientes que no mejoran con el tratamiento conservador son candidatos a métodos terapéuticos más agresivos, como lo son las inyecciones de anestésicos locales y esteroides, las cuales son útiles ya que a través del éxito terapéutico también reconfirman el diagnóstico y permiten realizar una rehabilitación menos dolorosa [1][5][16][21][27]. Fishman et al., [16] propusieron su protocolo de tratamiento. Una vez hecho el diagnostico, inyectan 1,5 ml de lidocaína 2% y 20 mg de acetónido de triamcinolona, con una aguja espinal de 23 - 25 G. Los pacientes fueron infiltrados utilizando reparos anatómicos y el punto de mayor dolor. Luego fueron sometidos a fisio-kinesioterapia, obteniendo una mejoría del 71,7%, a los cuatro años. La respuesta a las inyecciones puede ser inmediata, pero suele ser de corta duración.
El objetivo de nuestro trabajo es evaluar pacientes con diagnóstico clínico de SP a los cuales se les practicaron infiltraciones con anestésicos locales y esteroides, bajo guía tomográfica, siempre después de haber fracasado el tratamiento conservador.
Material y metodología
El estudio se llevó a cabo en el Hospital General de Agudos Juan A. Fernández de la Ciudad Autónoma de Buenos Aires, Argentina, entre enero de 2014 y abril de 2015.
Se trataron diez pacientes mediante infiltraciones con anestésicos locales y esteroides, bajo guía tomográfica. Todos presentaban diagnóstico clínico de SP refractario al tratamiento conservador. Siete eran mujeres y el promedio de edad fue de 51 (32 – 82) años (Tabla 1). No se observan diferencias estadísticas en la edad. En 4 pacientes el miembro inferior afectado fue el derecho y en un caso hubo afectación bilateral. El tiempo promedio de seguimiento fue 9 (0 – 17) meses.
El diagnóstico de SP se realizó tomando los criterios diagnósticos utilizados por Fishman et al., [22], incluyendo a quienes cumplían dos de los siguientes tres criterios diagnósticos: 1. dolor en la intersección del nervio ciático y el MP en la posición FADIR; 2. dolor exquisito, local o irradiado a la cara posterior del miembro inferior, a la compresión mecánica de la intersección del nervio ciático y el MP (la compresión mecánica reproduce el mecanismo patogénico) y 3. signo de Lassegue (+), entendido como una reducción mayor a 15° con respecto a la elevación dolorosa del miembro contralateral, o al reproducirse el dolor irradiado con una elevación menor a 65°. El EMG debía excluir miopatía y neuropatía. Al momento del diagnóstico, los pacientes habían manifestado el cuadro clínico durante una media de 35 (6 – 72) meses.
Cinco pacientes habían sido sometidos a bloqueos lumbares previamente, 3 de los cuales fueron bloqueos radiculares, un bloqueo epidural, y una de las pacientes había sido sometida a 2 bloqueos radiculares, un bloqueo epidural y una infiltración de Sturniolo. Esta última paciente había sido sometida previamente a una discectomía L5 S1, sin obtener mejoría del cuadro clínico. Tres pacientes habían sido sometidos previamente a infiltraciones de la articulación sacro-ilíaca, de los cuales dos fueron bajo guía tomográfica, y en un paciente se habían practicado dos infiltraciones previas de la articulación sacro-ilíaca; una con guía tomográfica, y la otra con guía fluoroscópica. Una paciente había sido sometido a una discectomía simple de L5 - S1, sin obtener resultados satisfactorios, por lo cual a los 2 años fue sometida a una artrodesis circunferencial por vía posterior del mismo espacio, sin mejoría del cuadro clínico.
En todos los pacientes con diagnóstico clínico de SP se realizaron radiografías lumbares (frente, perfil, Ferguson, ambas oblicuas, perfil en máxima flexión y máxima extensión) y de las caderas (frente y perfil), TC de pelvis y ambas caderas, RM de columna lumbar y de ambas caderas así como EMG en posición neutra para descartar neuropatía o miopatía. No se realizaron de forma rutinaria ecografía ni centellograma. Tampoco se realizó EMG en posición FADIR de forma rutinaria. Solo se realizó de manera prequirúrgica en la única paciente quirúrgica de la serie.
La infiltración se realizó con anestésicos locales y esteroides, con guía tomográfica, en pacientes que no habían logrado una mejoría del cuadro clínico con el tratamiento conservador. El tratamiento conservador consistió en administración de antiinflamatorios no esteroideos, analgésicos, relajantes musculares y antineuríticos asociados con fisio-kinesioterapia para elongar el MP, por un período no menor a 3 meses.
Los pacientes que se incluyeron en el estudio firmaron previamente a la realización del procedimiento el consentimiento informado.
No se les practicó infiltración con anestésicos locales y esteroides con guía tomográfica a los pacientes que a pesar de presentar 2 de los 3 criterios clínicos mencionados previamente tenían otra patología que justifique su cuadro clínico; tampoco se les practicó a aquellos que no firmaron el consentimiento informado.
El procedimiento fue realizado por el mismo cirujano ortopédico en todos los casos, siguiendo la misma técnica de infiltración, utilizando lidocaína 2% sin epinefrina (Xylocaina 2%®, Astrazeneca) y 1 ml de acetónido de triamcinolona 40 mg/ml (Fortcinolona 40®, Fortbenton Co. Laboratories S.A.).
El tomógrafo utilizado fue un equipo multicorte de 16 canales (Activion 16, Toshiba®) que fue operado en todos los procedimientos por el mismo técnico radiólogo.
A todos los pacientes se los evaluó con la Escala Visual Análoga (VAS de su sigla en inglés) previa al procedimiento, inmediatamente después del mismo, a los 2, 4 y 6 meses.
Técnica de infiltración percutánea guiada por TC
Se colocó a los pacientes en decúbito dorsal sobre la camilla del tomógrafo. Se llevó a cabo la maniobra FADIR. Se realizó dibujó, con un marcador dermográfico, el punto de mayor dolor, el cual a la compresión desencadenaba el dolor irradiado a la cara posterior del miembro inferior. Se colocó al paciente en decúbito ventral sobre la camilla del tomógrafo. Sobre ese punto marcado previamente se colocó una marca metálica como referencia para localizar las coordenadas tomográficas.
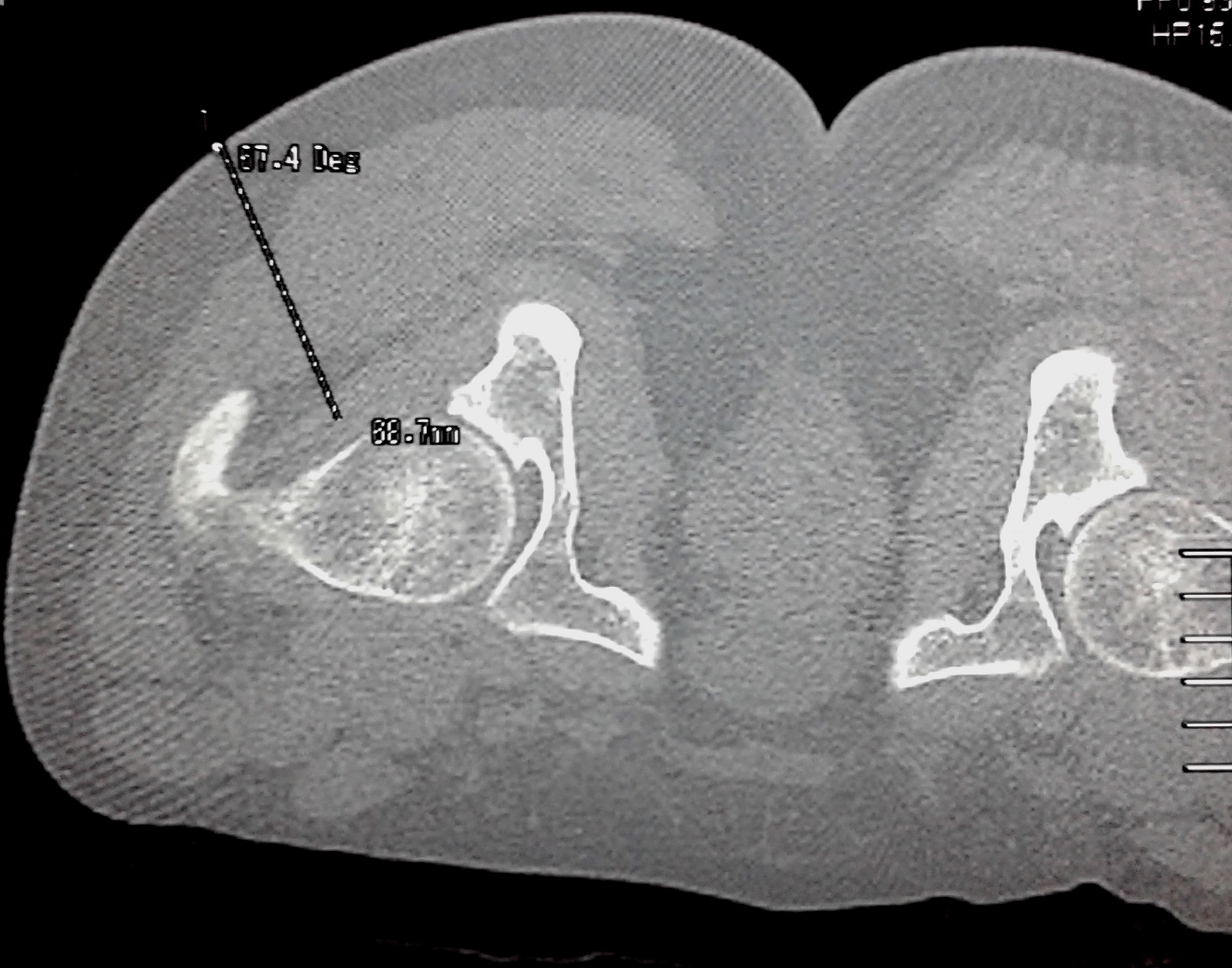
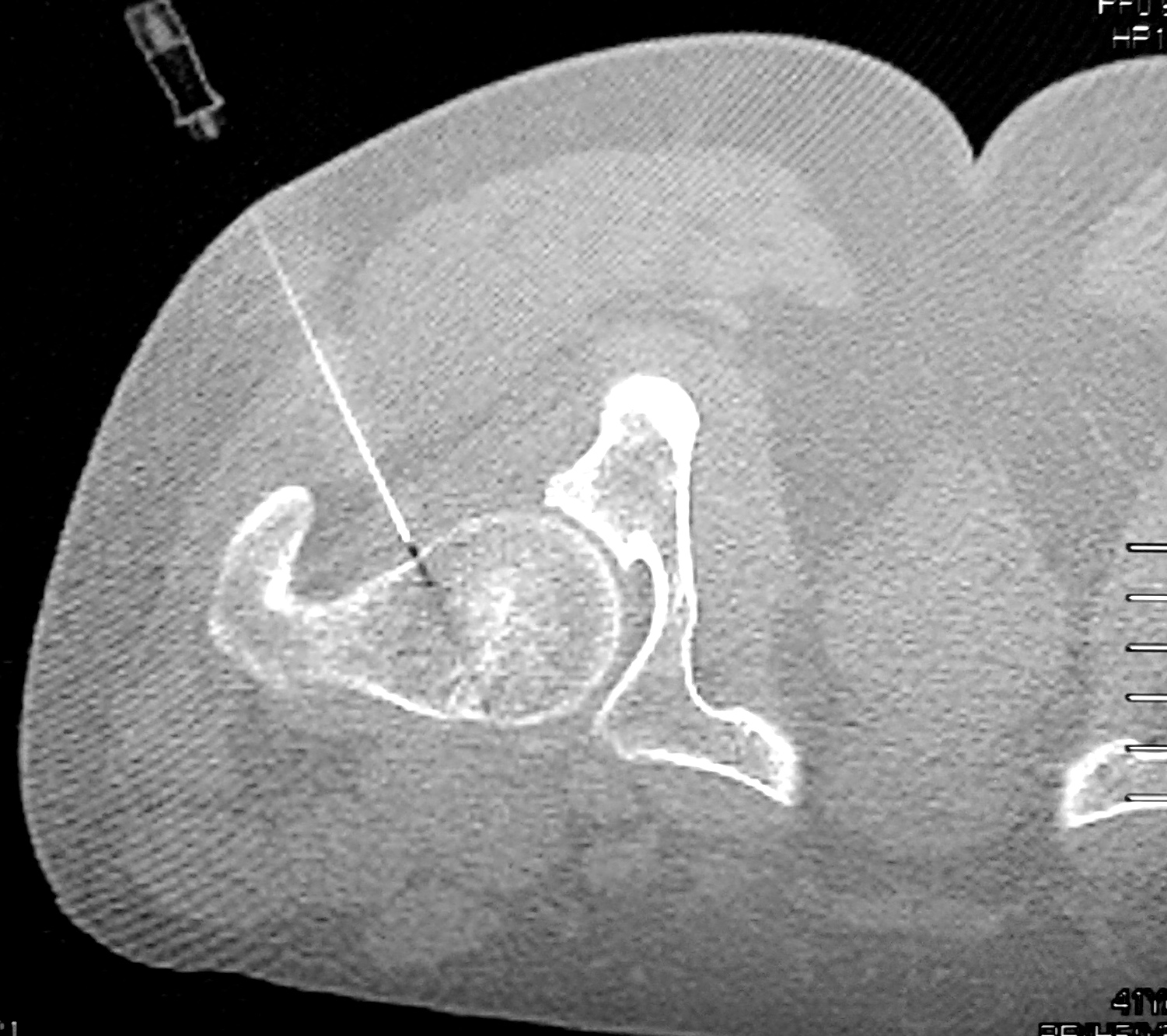
Se realizó el barrido tomográfico y se identificaron las imágenes correspondientes al sitio a infiltrar, ubicado 1 cm medial a la fosita del piramidal y 0,5 cm. posterior a la cápsula articular, es decir, ventral al MP y lateral al nervio ciático. Se registraron sus coordenadas tomográficas en el plano axial. También se registró la inclinación existente en el plano axial entre la marca metálica (punto de entrada) y el sitio a infiltrar, como así también la profundidad del plano (Figura 1).
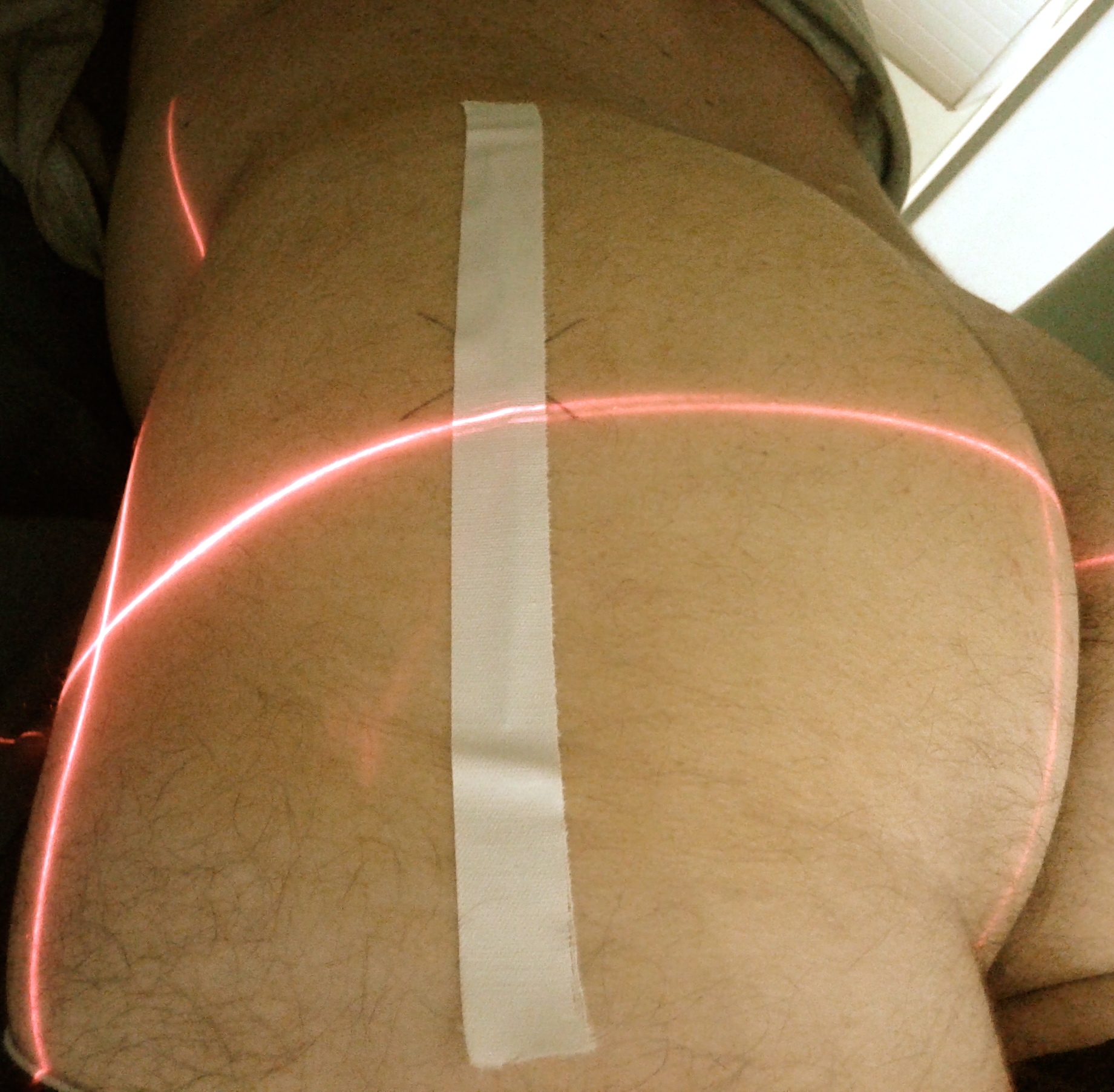
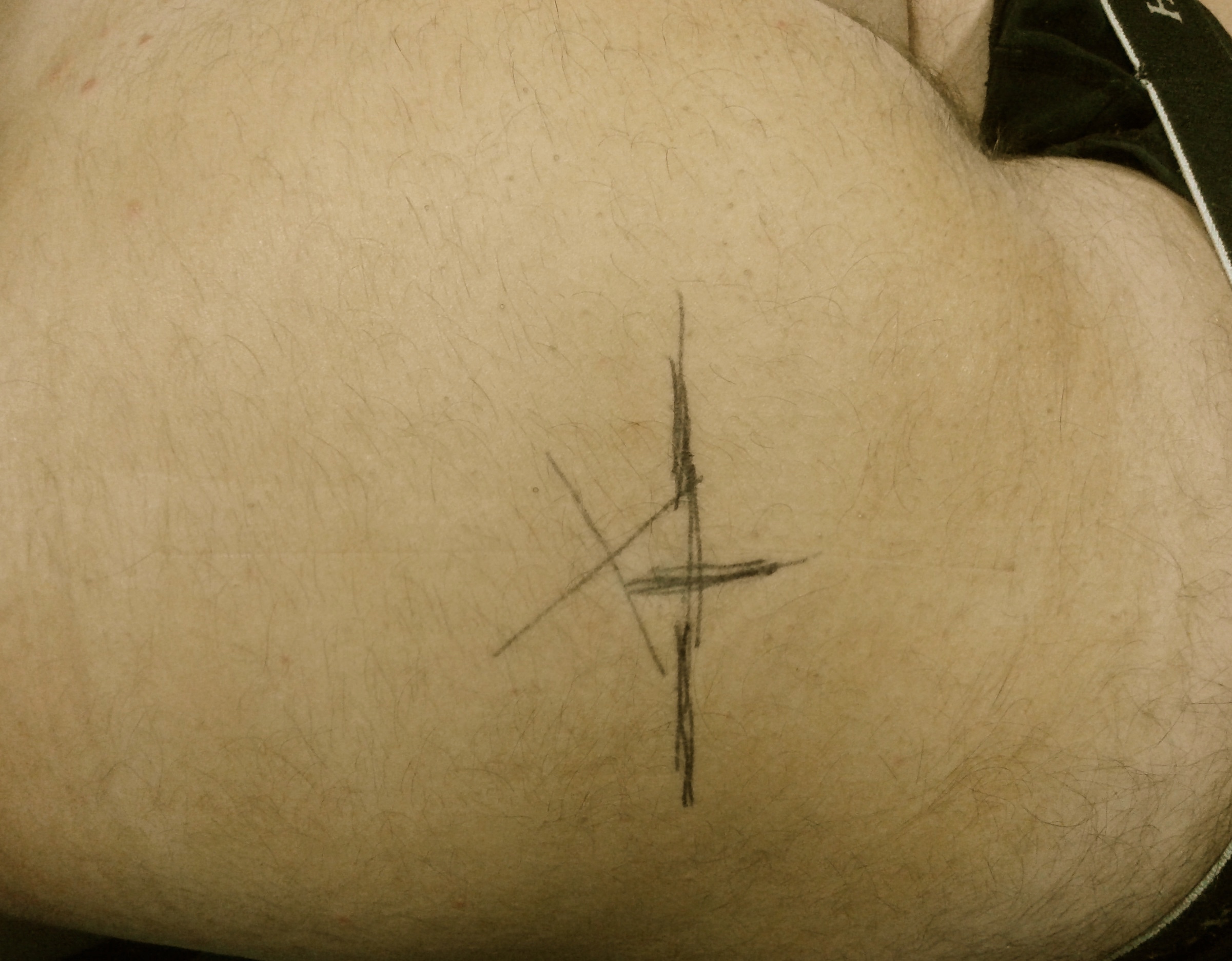
Se introdujeron las coordenadas tomográficas correspondientes al corte axial a utilizar, de tal manera que el equipo proyectaba una señal lumínica sobre el paciente (Figura 2). En la intersección entre la señal lumínica y la marca metálica se dibujó una nueva marca, la cual podía ser cefálica o podálica con respecto a la marca previa que marcaba el sitio gatillo del dolor en la posición FADIR. Esta nueva marca fue utilizada como punto de entrada para practicar la infiltración (Figura 3).
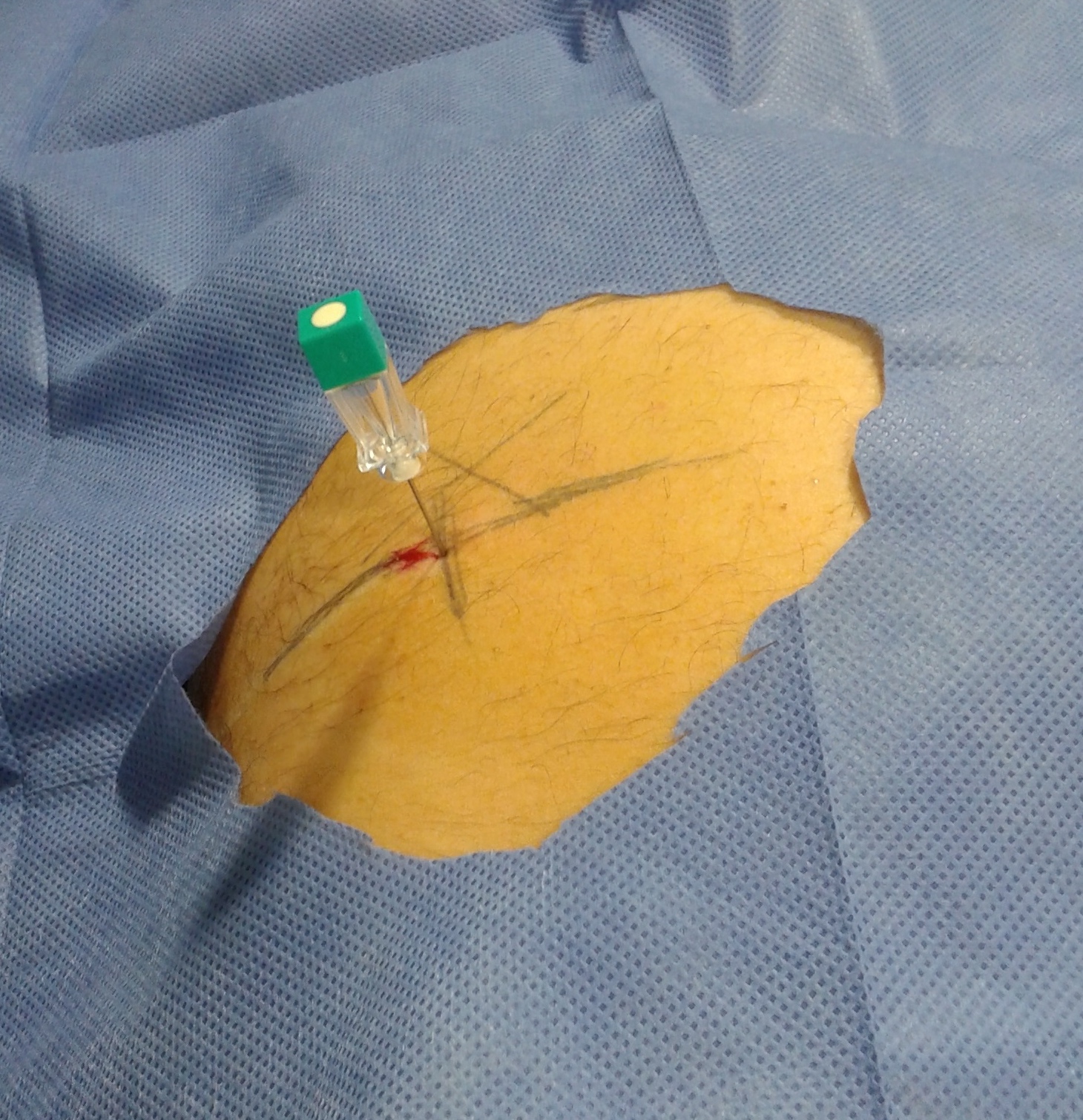
Se realizó un embrocado con solución iodada y se colocó un campo fenestrado estéril. Se realizó un habón cutáneo con 2 ml. de lidocaína al 2 % sin epinefrina. Se colocó una aguja espinal 21 G, con la inclinación planificada previamente en el plano axial al realizar el barrido tomogográfico. Se introdujo hasta la profundidad planificada previamente durante el barrido, hasta encontrar el tope óseo (Figura 4). Se obtuvo un nuevo corte axial con las coordenadas previamente registradas para confirmar la correcta posición de la punta de la aguja (Figura 5). Se retiró la aguja 0,5 cm. En este momento no se efectúa un nuevo barrido para disminuir la irradiación del paciente. Todos los pacientes refirieron la aparición del dolor irradiado a la cara posterior del miembro inferior al colocar la aguja en la región a infiltrar.
Se inyectó la solución preparada y se realizó una cura plana. Se indicó reposo por 24 horas y luego retorno a las actividades habituales y crioterapia 72 horas. No se indicó descarga de peso y la kinesioterapia comenzó a las 72 horas. Se indicaron antineuríticos durante el período de rehabilitación.
Análisis estadístico
Describimos las variables cuantitativas: promedio, desvío estándar, mediana, mínimo y máximo y comparamos las variables cuantitativas con factores o grupos, con la prueba de la T de Student para muestras relacionadas. La homocedasticidad se evaluó con la prueba de Levene y la normalidad con las pruebas de Kolmogorov Smirnov y Shapiro Wilks, además de evaluarlo con las pruebas gráficas de normalidad. En caso de estar alejados de la distribución normal y de rechazar homocedasticidad se usaron los test no paramétricos de Mann Whitney test de ANOVA robusta de Brown-Forsythe y Welch.
Las variables categóricas se compararon mediante la prueba de Chi-cuadrado con correcciones por continuidad de Yates. Para comparar los porcentajes se aplicó la prueba de proporciones (diferencia de porcentajes) con aproximación a Normal, cuando reunía las condiciones o con distribución binomial. Cuando se compararon más de dos grupos se aplicó la corrección de Bonferroni al nivel de significación.
En todos los casos los test estadísticos aplicados serán para muestras independientes y se usó un nivel de significación menor del 5% para rechazar la hipótesis nula. Todos los análisis estadísticos se realizaron utilizando los programas informáticos SPSS (versión 23), STATA 12, MS Excel 2013, Epidat 4.0.
Se trataron diez pacientes mediante infiltraciones con anestésicos locales y esteroides, bajo guía tomográfica. Todos presentaban diagnóstico clínico de SP refractario al tratamiento conservador. Siete eran mujeres y el promedio de edad fue de 51 (32 – 82) años (Tabla 1). No se observan diferencias estadísticas en la edad. En 4 pacientes el miembro inferior afectado fue el derecho y en un caso hubo afectación bilateral. El tiempo promedio de seguimiento fue 9 (0 – 17) meses.
Tabla 1. Distribución de edades por género del paciente
| Sexo | Media | Mediana | Desviación estándar | N | Mínimo | Máximo |
| Masculino | 52 | 41 | 27 | 3 | 32 | 82 |
| Femenino | 51 | 45 | 11 | 7 | 42 | 69 |
| Total | 51 | 45 | 15 | 10 | 32 | 82 |
El diagnóstico de SP se realizó tomando los criterios diagnósticos utilizados por Fishman et al., [22], incluyendo a quienes cumplían dos de los siguientes tres criterios diagnósticos: 1. dolor en la intersección del nervio ciático y el MP en la posición FADIR; 2. dolor exquisito, local o irradiado a la cara posterior del miembro inferior, a la compresión mecánica de la intersección del nervio ciático y el MP (la compresión mecánica reproduce el mecanismo patogénico) y 3. signo de Lassegue (+), entendido como una reducción mayor a 15° con respecto a la elevación dolorosa del miembro contralateral, o al reproducirse el dolor irradiado con una elevación menor a 65°. El EMG debía excluir miopatía y neuropatía. Al momento del diagnóstico, los pacientes habían manifestado el cuadro clínico durante una media de 35 (6 – 72) meses.
Cinco pacientes habían sido sometidos a bloqueos lumbares previamente, 3 de los cuales fueron bloqueos radiculares, un bloqueo epidural, y una de las pacientes había sido sometida a 2 bloqueos radiculares, un bloqueo epidural y una infiltración de Sturniolo. Esta última paciente había sido sometida previamente a una discectomía L5 S1, sin obtener mejoría del cuadro clínico. Tres pacientes habían sido sometidos previamente a infiltraciones de la articulación sacro-ilíaca, de los cuales dos fueron bajo guía tomográfica, y en un paciente se habían practicado dos infiltraciones previas de la articulación sacro-ilíaca; una con guía tomográfica, y la otra con guía fluoroscópica. Una paciente había sido sometido a una discectomía simple de L5 - S1, sin obtener resultados satisfactorios, por lo cual a los 2 años fue sometida a una artrodesis circunferencial por vía posterior del mismo espacio, sin mejoría del cuadro clínico.
En todos los pacientes con diagnóstico clínico de SP se realizaron radiografías lumbares (frente, perfil, Ferguson, ambas oblicuas, perfil en máxima flexión y máxima extensión) y de las caderas (frente y perfil), TC de pelvis y ambas caderas, RM de columna lumbar y de ambas caderas así como EMG en posición neutra para descartar neuropatía o miopatía. No se realizaron de forma rutinaria ecografía ni centellograma. Tampoco se realizó EMG en posición FADIR de forma rutinaria. Solo se realizó de manera prequirúrgica en la única paciente quirúrgica de la serie.
La infiltración se realizó con anestésicos locales y esteroides, con guía tomográfica, en pacientes que no habían logrado una mejoría del cuadro clínico con el tratamiento conservador. El tratamiento conservador consistió en administración de antiinflamatorios no esteroideos, analgésicos, relajantes musculares y antineuríticos asociados con fisio-kinesioterapia para elongar el MP, por un período no menor a 3 meses.
Los pacientes que se incluyeron en el estudio firmaron previamente a la realización del procedimiento el consentimiento informado.
No se les practicó infiltración con anestésicos locales y esteroides con guía tomográfica a los pacientes que a pesar de presentar 2 de los 3 criterios clínicos mencionados previamente tenían otra patología que justifique su cuadro clínico; tampoco se les practicó a aquellos que no firmaron el consentimiento informado.
El procedimiento fue realizado por el mismo cirujano ortopédico en todos los casos, siguiendo la misma técnica de infiltración, utilizando lidocaína 2% sin epinefrina (Xylocaina 2%®, Astrazeneca) y 1 ml de acetónido de triamcinolona 40 mg/ml (Fortcinolona 40®, Fortbenton Co. Laboratories S.A.).
El tomógrafo utilizado fue un equipo multicorte de 16 canales (Activion 16, Toshiba®) que fue operado en todos los procedimientos por el mismo técnico radiólogo.
A todos los pacientes se los evaluó con la Escala Visual Análoga (VAS de su sigla en inglés) previa al procedimiento, inmediatamente después del mismo, a los 2, 4 y 6 meses.
Técnica de infiltración percutánea guiada por TC
Se colocó a los pacientes en decúbito dorsal sobre la camilla del tomógrafo. Se llevó a cabo la maniobra FADIR. Se realizó dibujó, con un marcador dermográfico, el punto de mayor dolor, el cual a la compresión desencadenaba el dolor irradiado a la cara posterior del miembro inferior. Se colocó al paciente en decúbito ventral sobre la camilla del tomógrafo. Sobre ese punto marcado previamente se colocó una marca metálica como referencia para localizar las coordenadas tomográficas.
Se realizó el barrido tomográfico y se identificaron las imágenes correspondientes al sitio a infiltrar, ubicado 1 cm medial a la fosita del piramidal y 0,5 cm. posterior a la cápsula articular, es decir, ventral al MP y lateral al nervio ciático. Se registraron sus coordenadas tomográficas en el plano axial. También se registró la inclinación existente en el plano axial entre la marca metálica (punto de entrada) y el sitio a infiltrar, como así también la profundidad del plano (Figura 1).
Se introdujeron las coordenadas tomográficas correspondientes al corte axial a utilizar, de tal manera que el equipo proyectaba una señal lumínica sobre el paciente (Figura 2). En la intersección entre la señal lumínica y la marca metálica se dibujó una nueva marca, la cual podía ser cefálica o podálica con respecto a la marca previa que marcaba el sitio gatillo del dolor en la posición FADIR. Esta nueva marca fue utilizada como punto de entrada para practicar la infiltración (Figura 3).
Se inyectó la solución preparada y se realizó una cura plana. Se indicó reposo por 24 horas y luego retorno a las actividades habituales y crioterapia 72 horas. No se indicó descarga de peso y la kinesioterapia comenzó a las 72 horas. Se indicaron antineuríticos durante el período de rehabilitación.
Análisis estadístico
Describimos las variables cuantitativas: promedio, desvío estándar, mediana, mínimo y máximo y comparamos las variables cuantitativas con factores o grupos, con la prueba de la T de Student para muestras relacionadas. La homocedasticidad se evaluó con la prueba de Levene y la normalidad con las pruebas de Kolmogorov Smirnov y Shapiro Wilks, además de evaluarlo con las pruebas gráficas de normalidad. En caso de estar alejados de la distribución normal y de rechazar homocedasticidad se usaron los test no paramétricos de Mann Whitney test de ANOVA robusta de Brown-Forsythe y Welch.
Las variables categóricas se compararon mediante la prueba de Chi-cuadrado con correcciones por continuidad de Yates. Para comparar los porcentajes se aplicó la prueba de proporciones (diferencia de porcentajes) con aproximación a Normal, cuando reunía las condiciones o con distribución binomial. Cuando se compararon más de dos grupos se aplicó la corrección de Bonferroni al nivel de significación.
En todos los casos los test estadísticos aplicados serán para muestras independientes y se usó un nivel de significación menor del 5% para rechazar la hipótesis nula. Todos los análisis estadísticos se realizaron utilizando los programas informáticos SPSS (versión 23), STATA 12, MS Excel 2013, Epidat 4.0.
Resultados
La mejoría sintomática, fue evaluada mediante la VAS, tuvo un promedio de 8,4 (7 – 9) previo al procedimiento; de 2,7 (1 – 4) inmediatamente después del procedimiento; de 4 (2 – 8) a los 2 meses; de 4,5 (3 – 9) a los 4 meses y de 4,6 (3 – 7) a los 6 meses.
Se observan diferencias significativas, disminuyendo el puntaje entre las dos tomas en casi 6 puntos. Todos los pacientes refirieron un adormecimiento del miembro inferior ipsilateral luego del procedimiento, el cual no se extendió más allá de las 6 horas.
De los 10 pacientes sometidos al procedimiento, 4 fueron sometidos a una nueva infiltración mediante la misma técnica por reaparición del dolor, a las 18 (8 – 24) semanas, en promedio.
De los 4 pacientes sometidos a una nueva infiltración, todos presentaron una buena evolución evaluada mediante la VAS con un promedio de 7,7 (6 – 9) previo a la nueva infiltración; de 2,7 (2 – 4) inmediatamente después de la nueva infiltración; de 3,7 (3 – 6) a los 2 meses; de 4,2 (3 – 7) a los 4 meses y de 5 (3 – 8) a los 6 meses. Se observaron diferencias significativas, disminuyendo el puntaje entre las dos tomas en 5 puntos.
Una paciente a la que se le repitió la infiltración guiada por TC a las 24 semanas por desaparición del efecto inicial, manifestó una reaparición gradual de la sintomatología a las 24 semanas de la segunda infiltración. En esta paciente, que presentaba antecedentes de 2 cirugías lumbares bajas por presentar una ciatalgia refractaria interpretada como de origen espinal, se realizó un EMG de miembros inferiores comparativos en posición neutra de ambas caderas y en posición FADIR, el cual evidenció una prolongación del reflejo H en el nervio peroneo común en la posición FADIR del lado afectado. A esta paciente, luego de la confirmación del diagnóstico por electromiografía, se le propuso una liberación quirúrgica del MP asociada a neurolisis. Luego del procedimiento presentó una mejoría sintomática sostenida en el tiempo, según la VAS (8 pre-quirúrgica, 2 en el post operatorio inmediato, 2 a los 2 meses postoperatorios y 2 a los 4 meses postoperatorios). Se observan diferencias estadísticamente significativas, disminuyendo el puntaje entre las dos tomas en casi 4 puntos.
En una de las pacientes, la cual presentaba obesidad mórbida (IMC 37,4), hubo que utilizar un trocar de punción biopsia hepática percutánea, debido a la imposibilidad de alcanzar en profundidad (13,5 cm.) de manera percutánea el sitio a infiltrar con la aguja espinal utilizada habitualmente.
Ninguno de los pacientes estudiados presentó complicaciones inherentes al procedimiento (infecciones superficiales o profundas, necrosis cutáneas, hematomas, lesiones neurológicas o absorción masiva de los anestésicos locales).
En ninguna de las variables comparadas con la presencia o no de recidiva se observan diferencias de porcentajes entre los grupos (Tabla 2) (Tabla 3) (Tabla 4).
Se observan diferencias significativas, disminuyendo el puntaje entre las dos tomas en casi 6 puntos. Todos los pacientes refirieron un adormecimiento del miembro inferior ipsilateral luego del procedimiento, el cual no se extendió más allá de las 6 horas.
De los 10 pacientes sometidos al procedimiento, 4 fueron sometidos a una nueva infiltración mediante la misma técnica por reaparición del dolor, a las 18 (8 – 24) semanas, en promedio.
De los 4 pacientes sometidos a una nueva infiltración, todos presentaron una buena evolución evaluada mediante la VAS con un promedio de 7,7 (6 – 9) previo a la nueva infiltración; de 2,7 (2 – 4) inmediatamente después de la nueva infiltración; de 3,7 (3 – 6) a los 2 meses; de 4,2 (3 – 7) a los 4 meses y de 5 (3 – 8) a los 6 meses. Se observaron diferencias significativas, disminuyendo el puntaje entre las dos tomas en 5 puntos.
Una paciente a la que se le repitió la infiltración guiada por TC a las 24 semanas por desaparición del efecto inicial, manifestó una reaparición gradual de la sintomatología a las 24 semanas de la segunda infiltración. En esta paciente, que presentaba antecedentes de 2 cirugías lumbares bajas por presentar una ciatalgia refractaria interpretada como de origen espinal, se realizó un EMG de miembros inferiores comparativos en posición neutra de ambas caderas y en posición FADIR, el cual evidenció una prolongación del reflejo H en el nervio peroneo común en la posición FADIR del lado afectado. A esta paciente, luego de la confirmación del diagnóstico por electromiografía, se le propuso una liberación quirúrgica del MP asociada a neurolisis. Luego del procedimiento presentó una mejoría sintomática sostenida en el tiempo, según la VAS (8 pre-quirúrgica, 2 en el post operatorio inmediato, 2 a los 2 meses postoperatorios y 2 a los 4 meses postoperatorios). Se observan diferencias estadísticamente significativas, disminuyendo el puntaje entre las dos tomas en casi 4 puntos.
En una de las pacientes, la cual presentaba obesidad mórbida (IMC 37,4), hubo que utilizar un trocar de punción biopsia hepática percutánea, debido a la imposibilidad de alcanzar en profundidad (13,5 cm.) de manera percutánea el sitio a infiltrar con la aguja espinal utilizada habitualmente.
Ninguno de los pacientes estudiados presentó complicaciones inherentes al procedimiento (infecciones superficiales o profundas, necrosis cutáneas, hematomas, lesiones neurológicas o absorción masiva de los anestésicos locales).
En ninguna de las variables comparadas con la presencia o no de recidiva se observan diferencias de porcentajes entre los grupos (Tabla 2) (Tabla 3) (Tabla 4).
Tabla 2. Duración de la sintomatología previa al diagnóstico de SP (meses)
| Sexo | Media | Mediana | Desviación estándar | N | Mínimo | Máximo |
| Masculino | 30 | 12 | 36 | 3 | 6 | 72 |
| Femenino | 38 | 36 | 15 | 7 | 24 | 60 |
| Total | 35 | 30 | 21 | 10 | 6 | 72 |
Tabla 3. Distribución de frecuencias y porcentajes para las variables principales estudiadas.
| Variable | Frecuencia | % | |
| Sexo | Masculino | 3 | 30% |
| Femenino | 7 | 70% | |
| Bloqueo lumbar previo | Si | 5 | 50% |
| No | 5 | 50% | |
| Bloqueo lumbar sacro previo | Si | 3 | 30% |
| No | 7 | 70% | |
| Bloqueos previos | No | 5 | 50% |
| Lumbar | 3 | 30% | |
| Lumbar y sacro | 2 | 20% | |
| Recidiva | Si | 4 | 40% |
| No | 6 | 60% | |
| Lateralidad | Derecha | 4 | 40% |
| Izquierda | 5 | 50% | |
| Bilateral | 1 | 10% | |
Tabla 4. Distribución de frecuencias y porcentajes para las variables principales estudiadas por Recidiva.
| Variable | Recidiva | ||||
| Si | No | ||||
| Frecuencia | % | Frecuencia | % | ||
| Sexo | Masculino | 1 | 33,3% | 2 | 66,7% |
| Femenino | 3 | 42,9% | 4 | 57,1% | |
| Bloqueo lumbar previo | Si | 3 | 60,0% | 2 | 40,0% |
| No | 1 | 20,0% | 4 | 80,0% | |
| Bloqueo lumbar sacro previo | Si | 1 | 33,3% | 2 | 66,7% |
| No | 3 | 42,9% | 4 | 57,1% | |
| Bloqueos previos | No | 1 | 20,0% | 4 | 80,0% |
| Lumbar | 2 | 66,7% | 1 | 33,3% | |
| Lumbar y sacro | 1 | 50,0% | 1 | 50,0% | |
| Lateralidad | Derecha | 2 | 50,0% | 2 | 50,0% |
| Izquierda | 1 | 20,0% | 4 | 80,0% | |
| Bilateral | 1 | 100,0% | 0 | 0,0% | |
Discusión
El SP es un cuadro relativamente infrecuente de dolor en la región glútea que puede asociarse o no a irradiación hacia la cara posterior del miembro inferior ipsilateral, siguiendo la distribución del nervio ciático. Generalmente se lo considera como un diagnóstico de exclusión [28].
No se conoce con exactitud cuáles son sus factores causales, pero es ampliamente reconocido como desencadenante, un evento traumático cerrado en la región glútea, que provoca un espasmo en el MP, seguido de edema y contractura muscular con la consecuente compresión y atrapamiento del nervio ciático [29]. Otras posibles causas incluyen hipertrofia del MP por sobreuso, un espasmo reflejo del MP, un recorrido anómalo del nervio ciático a través del MP [30] o de su tendón [31].
El tratamiento inicial del SP, incluye la administración de anti inflamatorios no esteroideos, relajantes musculares, analgésicos, drogas para el tratamiento del dolor neuropático y fisio-kinesioterapia con el objetivo de elongar el MP y cortar el circulo vicioso de espasmo, compresión nerviosa y dolor [24].
En los casos refractarios al tratamiento incruento, se indican infiltraciones de anestésicos locales y esteroides o de toxina botulínica. Benzon et al., [20] señalaron mejoría sintomática a los 3 meses, en 16 de 19 pacientes, mediante infiltración guiada por radioscopia y neuroestimulación. A pesar de los resultados satisfactorios reportados en la bibliografía utilizando la técnica de infiltración que toma en cuenta los reparos anatómicos de superficie, creemos que cuenta con limitantes como lo son la perdida de dichos reparos en pacientes con obesidad, la imposibilidad para calcular la profundidad a la cual debe ser inyectada la solución o la posibilidad de lesión de estructuras neurovasculares existentes en esta región anatómica [32]. Mediante nuestra técnica de infiltración de anestésicos locales y esteroides bajo guía tomográfica, creemos que estos inconvenientes pueden ser zanjados. Nuestra técnica presenta como inconveniente la irradiación para el paciente debido al uso del tomógrafo.
Los procedimientos quirúrgicos mediante los cuales se practica una desinserción del MP con neurolisis del nervio ciático se reservan para los casos en los cuales fallaron todos los tratamientos previamente descritos [24].
La infiltración con anestésicos locales y esteroides bajo guía tomográfica como parte del tratamiento del SP nos permite obtener una mejoría sintomática estadísticamente significativa, con la ventaja de poder visualizar el sitio exacto a infiltrar, evitando lesionar estructuras neuro-vasculares.
No se conoce con exactitud cuáles son sus factores causales, pero es ampliamente reconocido como desencadenante, un evento traumático cerrado en la región glútea, que provoca un espasmo en el MP, seguido de edema y contractura muscular con la consecuente compresión y atrapamiento del nervio ciático [29]. Otras posibles causas incluyen hipertrofia del MP por sobreuso, un espasmo reflejo del MP, un recorrido anómalo del nervio ciático a través del MP [30] o de su tendón [31].
El tratamiento inicial del SP, incluye la administración de anti inflamatorios no esteroideos, relajantes musculares, analgésicos, drogas para el tratamiento del dolor neuropático y fisio-kinesioterapia con el objetivo de elongar el MP y cortar el circulo vicioso de espasmo, compresión nerviosa y dolor [24].
En los casos refractarios al tratamiento incruento, se indican infiltraciones de anestésicos locales y esteroides o de toxina botulínica. Benzon et al., [20] señalaron mejoría sintomática a los 3 meses, en 16 de 19 pacientes, mediante infiltración guiada por radioscopia y neuroestimulación. A pesar de los resultados satisfactorios reportados en la bibliografía utilizando la técnica de infiltración que toma en cuenta los reparos anatómicos de superficie, creemos que cuenta con limitantes como lo son la perdida de dichos reparos en pacientes con obesidad, la imposibilidad para calcular la profundidad a la cual debe ser inyectada la solución o la posibilidad de lesión de estructuras neurovasculares existentes en esta región anatómica [32]. Mediante nuestra técnica de infiltración de anestésicos locales y esteroides bajo guía tomográfica, creemos que estos inconvenientes pueden ser zanjados. Nuestra técnica presenta como inconveniente la irradiación para el paciente debido al uso del tomógrafo.
Los procedimientos quirúrgicos mediante los cuales se practica una desinserción del MP con neurolisis del nervio ciático se reservan para los casos en los cuales fallaron todos los tratamientos previamente descritos [24].
La infiltración con anestésicos locales y esteroides bajo guía tomográfica como parte del tratamiento del SP nos permite obtener una mejoría sintomática estadísticamente significativa, con la ventaja de poder visualizar el sitio exacto a infiltrar, evitando lesionar estructuras neuro-vasculares.
Referencias
- Robinson DR. Pyriformis syndrome in relation to sciatic pain. Am J Surg. 1947; 73:355-8.
- Stewart JD. The piriformis syndrome is overdiagnosed. Muscle Nerve. 2003; 28:644-6.
- Beatty RA. The piriformis muscle syndrome: a simple diagnostic maneuver. Neurosurgery. 1994; 34:512-4.
- Sayson SC, Ducey JP, Maybrey JB, Wesley RL, Vermilion D. Sciatic entrapment neuropathy associated with an anomalous piriformis muscle. Pain. 1994; 59:149-52.
- Pace JB, Nagle D. Piriform syndrome. West J Med. 1976; 124:435-9.
- Bernard TN Jr, Kirkaldy-Willis WH. Recognizing specific characteristics of nonspecific low back pain. Clin Orthop Relat Res. 1987; 217:266-80.
- Parziale JR, Hudgins TH, Fishman LM. The piriformis syndrome. Am J Orthop (Belle Mead NJ). 1996; 25:819-23.
- Fishman LM, Anderson C, Rosner B. Botox and physical therapy in the treatment of piriformis syndrome. Am J Phys Med Rehabil. 2002; 81:936-42.
- Foster MR. Piriformis syndrome. Orthopedics. 2002; 25:821-5.
- Papadopoulos EC, Korres DS, Papachristou G, Efstathopoulos N. Piriformis syndrome. Orthopedics. 2004; 27:797.
- Benson ER, Schutzer SF. Posttraumatic piriformis syndrome: diagnosis and results of operative treatment. J Bone Joint Surg (Am). 1999; 81-A:941-9.
- Hughes SS, Goldstein MN, Hicks DG, Pellegrini VD Jr. Extrapelvic compression of the sciatic nerve. An unusual cause of pain about the hip: report of five cases. J Bone Joint Surg (Am). 1992; 74-A:1553-9.
- Barton PM. Piriformis syndrome: a rational approach to management. Pain. 1991; 47:345-52.
- Rodrigue T, Hardy RW. Diagnosis and treatment of piriformis syndrome. Neurosurg Clin N Am. 2001; 12:311-9.
- Chen WS. Bipartite piriformis muscle: an unusual cause of sciatic nerve entrapment. Pain. 1994; 58:269-72.
- Fishman LM, Dombi GW, Michaelsen C, Ringel S, Rozbruch J, Rosner B, et al. Piriformis syndrome: diagnosis, treatment, and outcome--a 10-year study. Arch Phys Med Rehabil. 2002; 83:295-301.
- Pecina M. Contribution to the etiological explanation of the piriformis syndrome. Acta Anat (Basel). 1979; 105:181-7.
- Fishman LM, Zybert PA. Electrophysiologic evidence of piriformis syndrome. Arch Phys Med Rehabil. 1992; 73:359-64.
- Brown JA, Braun MA, Namey TC. Pyriformis syndrome in a 10-year-old boy as a complication of operation with the patient in the sitting position. Neurosurgery. 1988; 23:117-9.
- Benzon HT, Katz JA, Benzon HA, Iqbal MS. Piriformis syndrome: anatomic considerations, a new injection technique, and a review of the literature. Anesthesiology. 2003; 98:1442-8.
- Filler AG, Haynes J, Jordan SE, Prager J, Villablanca JP, Farahani K, et al. Sciatica of nondisc origin and piriformis syndrome: diagnosis by magnetic resonance neurography and interventional magnetic resonance imaging with outcome study of resulting treatment. J Neurosurg Spine. 2005; 2:99-115.
- Lee EY, Margherita AJ, Gierada DS, Narra VR. MRI of piriformis syndrome. AJR Am J Roentgenol. 2004; 183:63-4.
- McCrory P, Bell S. Nerve entrapment syndromes as a cause of pain in the hip, groin and buttock. Sports Med. 1999; 27:261-74.
- Beauchesne RP, Schutzer SF. Myositis ossificans of the piriformis muscle: an unusual cause of piriformis syndrome. A case report. J Bone Joint Surg (Am). 1997; 79-A:906-10.
- Julsrud ME. Piriformis syndrome. J Am Podiatr Med Assoc. 1989; 79:128-31.
- Vandertop WP, Bosma NJ. The piriformis syndrome. A case report. J Bone Joint Surg (Am). 1991; 73-A:1095-7.
- Jankiewicz JJ, Hennrikus WL, Houkom JA. The appearance of the piriformis muscle syndrome in computed tomography and magnetic resonance imaging. A case report and review of the literature. Clin Orthop Relat Res. 1991; 262:205-9.
- Silver JK, Leadbetter WB. Piriformis syndrome: assessment of current practice and literature review. Orthopedics. 1998; 21:1133-5.
- Papadopoulos SM, McGillicuddy JE, Albers JW. Unusual cause of 'piriformis muscle syndrome'. Arch Neurol. 1990; 47:1144-6.
- Uchio Y, Nishikawa U, Ochi M, Shu N, Takata K. Bilateral piriformis syndrome after total hip arthroplasty. Arch Orthop Trauma Surg. 1998; 117:177-9.
- Ozaki S, Hamabe T, Muro T. Piriformis syndrome resulting from an anomalous relationship between the sciatic nerve and piriformis muscle. Orthopedics. 1999; 22:771-2.
- Kirschner JS, Foye PM, Cole JL. Piriformis syndrome, diagnosis and treatment. Muscle Nerve. 2009; 40:10-8.