Enclavijado cefalomedular y artropastia de cadera para el tratamiento de metástasis óseas en el fémur proximal
Cephalomedullary nailing and hip arthroplasty as treatment for proximal femur bone metastasis
- RAMIRO SOCA SUAREZ - Autor principal (Instituto Nacional de Ortopedia y Traumatologia)
- NICOLÁS CASALES
- LUIS FRANCESCOLI URIARTE
- ROGELIO REY
- CLAUDIO SILVERI
RAMIRO SOCA SUAREZ
Instituto Nacional de Ortopedia y Traumatologia
email: ramirosoca@icloud.com
Resumen
Material y métodos: estudio descriptivo, retrospectivo, observacional de pacientes con lesiones metastásicas con riesgo de fractura o fractura patológica pertrocantérica o subtrocantérica, operadas entre 2014 y 2017, por el mismo cirujano. Se incluyeron 18 pacientes, con 20 fracturas de fémur proximales. El rango de edad fue de 40 a 88 años, con un seguimiento medio de 12 meses para los pacientes a los que se les colocó una prótesis y de 5 meses a los pacientes que se les realizó un ECM. Las metástasis fueron consecuencia de neoplasia primaria de mama, próstata y pulmón respectivamente. Para la valoración se utilizaron los scores de Karnofsky y el ECOG scores.
Resultados: Se registraron 2 complicaciones post operatorias. La medición de la escala EVA preoperatorio fue 8 (DE = 1) y en el posoperatorio la media fue 4 (DE: 1,5) (p<0,001). Once pacientes deambularon (61%). El score de Karnofsky mostró valores iguales a 60 y 70 en el 50% de los pacientes, y de 80 y 90 en el 50% restante. La mediana de sobrevida fue de 27 meses. No se encontraron diferencias significativas en la sobrevida con ambos tipos de implantes (p=0,42).
Conclusión: cualquiera de los dos implantes estudiados son aceptables ya que no hay diferencia en sobrevida, funcionalidad y complicaciones entre los mismos en las metástasis del fémur proximal.
Abstract
Material and methods: a descriptive, retrospective, observational study of patients with metastatic lesions with risk of pathological fracture or pertrochanteric and subtrochanteric fractures operated, between 2014 and 2017, by the same surgeon. The study included 18 patients and 20 proximal femur fractures. The age range was from 40 to 88 years, the follow-up was 12 months for patients who underwent a prosthesis and 5 months for patients who underwent an ECM. The primary neoplasm corresponded to breast, prostate and lung respectively. The Karnofsky scores and the ECOG scores were used.
Results: There were 2 post-operative complications. The measurement of the preoperative EVA scale had an average of 8 (SD = 1); while in the postoperative period it had an average of 4 (SD = 1.5) (p<0.001). Eleven patients walked (61%). The Karnofsky score showed values equal to 60 and 70 in 50% of the patients, and of 80 and 90 in the remaining 50%. The median survival time was 27 months. No significant differences were found in the survival of both types of implants (p = 0.42).
Conclusions: any of the implants studied is acceptable since there is no difference in survival, functionality and complications among them in metastases of the proximal femur.
Introducción
Las metástasis óseas del fémur proximal se pueden tratar quirúrgicamente utilizando la escala de valoración de Mirels o Harrington [2-5]. Este tipo de lesiones se pueden resolver mediante la utilización de una de estas estrategias quirúrgicas las cuales conllevan un implante diferente: reconstrucción con endoprotesis no convencional; enclavijado cefalomedular o dispositivo placa-bulón (DHS) con o sin cemento (RAFI). La decisión de que estrategia quirúrgica utilizar en las lesiones de la región trocantérica y subtrocantérica no está bien definido. El objetivo de nuestro estudio fue evaluar los pacientes que presentaron lesiones metastásicas de fémur proximal (excluidos cabeza y cuello) tratados con prótesis y enclavijado cefalomedular, valorando funcionalidad, sobrevida y complicaciones.
Material y metodología
Los criterios de inclusión fueron pacientes con diagnóstico de metástasis en el fémur proximal en región pertrocantérica y subtrocantérica operados entre enero de 2014 y abril 2017, operados por el mismo cirujano habiendo firmado el consentimiento informado. Se excluyeron los tumores óseos primarios, los pacientes que presentaron solamente lesiones o fractura de cuello y/o cabeza femoral, el mieloma múltiple y los pacientes menores de 15 años.
Se estudiaron 18 pacientes (20 fémur proximales) y la elección del implante a utilizar fue decidida por un equipo multidisciplinario, teniendo en cuenta el tipo de lesión, lítico, blástico o mixto, su extensión, tamaño de la misma, si se trata de fractura o profilaxis y la expectativa de vida del paciente.
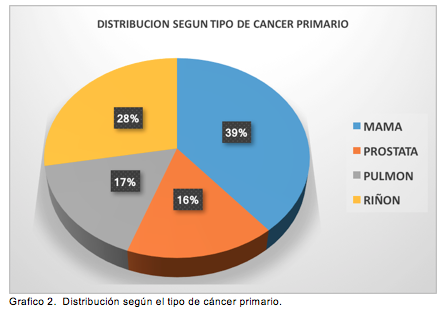
De los 18 pacientes incluidos, 12 eran mujeres y 6 hombres. El rango de edad fue de 40 a 88 años, con una media de 61 (DE: 13) años. Los implantes fueron 11 enclavijados cefalomedulares y 9 prótesis. Trece pacientes (72%) estaban afectados del lado derecho, 3 pacientes (17%) del lado izquierdo y 2 pacientes (11%) de ambos lados. Catorce cirugías correspondieron a fracturas (75%), 7 a profilaxis (25%) (Tabla 1). Las metástasis correspondieron a neoplasias primarias de mama en 7 pacientes (39%), riñón en 4 pacientes (22%), próstata y pulmón con 3 pacientes cada uno (16,5%) y un caso de riñón y páncreas (6%). El seguimiento fue de 12 (rango: 3 - 30) meses para los pacientes con una prótesis y de 5 (rango: 1 - 9) meses a los pacientes con ECM (Tabla 1) (Figura 1).
Entre los 9 pacientes a los que se les colocó una prótesis, 4 recibieron una prótesis total (2 prótesis convencionales y 2 no convencionales) y a 5 pacientes se les colocó una prótesis parcial de tipo no convencional (Tabla 2) (Figura 2) (Figura 3).
En la internación pre operatoria se realizó cuestionario y escala de Karnofsky [9] para medir la capacidad de los pacientes con cáncer para realizar tareas rutinarias. Los puntajes de la escala de rendimiento de Karnofsky oscilan entre 0 y 100: también se les realizo la escala del Eastern Cooperative Oncology Group (ECOG) para conocer la evolución de las capacidades del paciente en su vida diaria manteniendo al máximo su autonomía, la misma se puntúa de 0 a 5, siendo cero el paciente asintomático y 5 el paciente fallecido. De acuerdo con las características radiográficas de las lesiones, estadificación del paciente y tipo de tumor primario, se realizó el baremo del Scandinavian Sarcoma Group [10] que valora la expectativa de vida del paciente. El puntaje funcional MSTS [9] se utilizó para la evaluación clínica y funcional después de la cirugía. Este puntaje asigna valores numéricos (0-5) para cada una de las 6 categorías; por lo tanto, el puntaje varía de 0 a 30. Se compone de tres categorías generales (dolor, función y aceptación emocional) y tres categorías específicas de extremidades inferiores (apoyo, caminar y marcha) [11]. Los datos se presentaron con distribución de frecuencias para variables cualitativas y medidas de resumen para variables cuantitativas. Se aplicó test T de Student para la comparación de medias dependientes. Se consideraron significativos valores p inferiores al 5%.
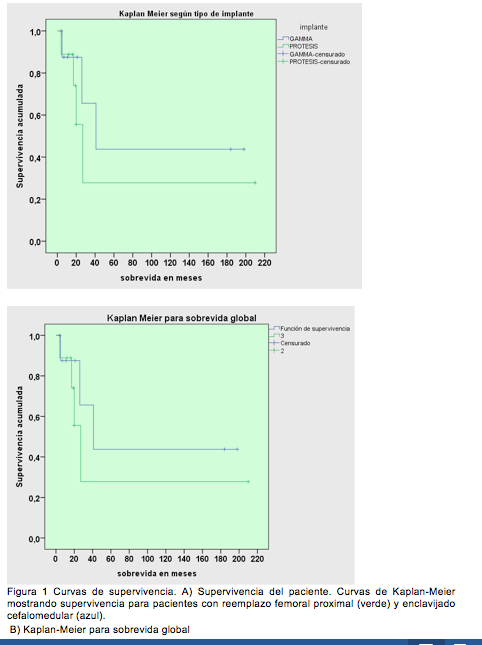
La sobrevida se mostró con curvas de supervivencia de Kaplan-Meier.
| Edad (años) | lado | sexo | Tumor primario | Tiempo diagnóstico | Fractura profilaxis | MSTS | Karnofsky | ECOG | SSG | EVA pre | EVA post | |
| 1 | 67 | D | M | Riñón - páncreas | 15 a | 1 | 25 | 90 | 1 | 1 | 7 | 2 |
| 2 | 59 | D | V | Pulmón | 1 m | 1 | 8 | 60 | 1 | 4 | 8 | 5 |
| 3 | 55 | D | M | Riñón | 1 m | 1 | 27 | 90 | 1 | 0 | 7 | 2 |
| 4 | 55 | D | V | Riñón | 5 m | 1 | 27 | 90 | 1 | 1 | 8 | 2 |
| 5 | 68 | D | M | Riñón | 2 a | 1 | 8 | 70 | 2 | 2 | 8 | 5 |
| 6 | 42 | D | M | Riñón | 1 a | 1 | 10 | 60 | 2 | 4 | 8 | 6 |
| 7 | 40 | D | M | Mama | 6 m | 1 | 19 | 70 | 2 | 3 | 9 | 3 |
| 8 | 62 | D | V | Próstata | 10 m | 1 | 23 | 90 | 1 | 3 | 8 | 3 |
| 9 | 55 | I | M | Mama | 1 | 20 | 80 | 1 | 2 | 8 | 3 | |
| 10 | 58 | Bilat | M | Mama | 1 a | 2,2 | 19 | 60 | 2 | 3 | 8 | 5 |
| 11 | 67 | Bilat | M | Mama | 16 a | 1,2 | 21 | 70 | 2 | 3 | 8 | 5 |
| 12 | 62 | D | V | Pulmón | 4 m | 2,2 | 24 | 90 | 1 | 3 | 8 | 4 |
| 13 | 82 | D | V | Próstata | 8 m | 1 | 22 | 90 | 1 | 2 | 5 | 2 |
| 14 | 51 | I | M | Mama | 15 a | 2 | 25 | 90 | 1 | 2 | 8 | 3 |
| 15 | 85 | I | V | Próstata | 3 a | 1 | 6 | 60 | 4 | 3 | 8 | 5 |
| 16 | 58 | D | M | Pulmón | 3 m | 1 | 6 | 70 | 2 | 3 | 8 | 6 |
| 17 | 60 | D | M | Mama | 2 a | 1 | 5 | 60 | 2 | 4 | 9 | 7 |
| 18 | 50 | D | M | Mama | 1 m | 26 | 90 | 1 | no | 1 | 9 | 5 |
(D = derecho; I = izquierdo; M = mujer; V = varón)
Resultados
Se registraron 2 complicaciones post-operatorias, una infección de herida quirúrgica con sepsis y una luxación de prótesis (Tabla 2).
La medición de la escala EVA previa a la cirugía tuvo un mínimo de 5 y un máximo de 9, con una media de 8 (DE: 1); en tanto en el post-operatorio el mínimo fue de 2, el máximo de 7, con una media de 4 (DE: 1,5). La reducción de la escala de dolor fue significativa (p<0,001), con una diferencia de 4 puntos. Ningún paciente manifestó un aumento del EVA tras la cirugía.
Once pacientes deambularon (61%), 8 de ellos con andador; en tanto 7 pacientes (39%) no deambularon (Tabla 2).
La valoración de capacidad funcional ECOG mostró 10 pacientes con grado 1 (55,5%), 7 pacientes con grado 2 (39%) y un paciente (5,5%) con grado 4. El baremo de Karnofsky mostró valores iguales a 60 y 70, en el 50% de los pacientes, y de 80 y 90 en el 50% restante. La mortalidad acumulada para el grupo de pacientes fue del 38,9% y la mediana de sobrevida fue de 27 meses.
No se encontró diferencias significativas en la sobrevida de ambos tipos de implantes (p=0,423). La mediana de sobrevida para pacientes que se les coloco un ECM fue de 41 meses y para pacientes que se les coloco una prótesis de 27 meses (Tabla 2) (Figura 4).
| Caso | Implante | complicaciones | deambular | seguimiento | sobrevida |
| 1 | Prótesis | Si | 30 m | Si | |
| 2 | Prótesis | No | 3 m | No3 m | |
| 3 | Prótesis | Si | 18 m | Si | |
| 4 | Prótesis | luxación | Andador | 15 m | No 14 m |
| 5 | Prótesis | No | 3 m | No 3 m | |
| 6 | Prótesis | infección | No | 4 m | No 4 m |
| 7 | Prótesis | Andador | 6 m | Si | |
| 8 | Prótesis | Andador | 6 m | Si | |
| 9 | Prótesis | Andador | 20 m | Si | |
| 10 | Clavo γ | Andador | 9 m | Si | |
| 11 | Clavo γ | No | 6 m | Si | |
| 12 | Clavo γ | Andador | 3 m | Si | |
| 13 | Clavo γ | Andador | 3 m | Si | |
| 14 | Clavo γ | Si | 4 m | Si | |
| 15 | Clavo γ | No | 1 m | No 1 m | |
| 16 | Clavo γ | No | 2 m | No 2 m | |
| 17 | Clavo γ | No | 2 m | No 2 m | |
| 18 | Clavo γ | Si | Si |
Discusión
Reconocemos varias limitaciones en este estudio ya que es un diseño retrospectivo y el número de pacientes es pequeño. Sabemos que las lesiones metastásicas en el fémur proximal ocurren de forma muy diversa, con una variedad de diagnósticos en diferentes etapas de la enfermedad, con diferentes características de lesión, a los pacientes que tenían como cáncer primario mama o próstata se los enclavijó, en cambio a los pacientes con un tumor primario de pulmón o riñón se les implantó una prótesis. Cada tratamiento de cada paciente debe ser individualizado de acuerdo a su situación clínica, por lo que es difícil llevar a cabo un estudio comparando una técnica quirúrgica con otra. A pesar de esto, todos los pacientes fueron tratados en una institución que utiliza los mismos criterios de selección, no siendo aleatorizada la elección del tipo de implante pues dependió del tipo de neoplasia primaria, el estado general del paciente, el tipo de lesión destructiva de hueso, la extensión hacia la zona vecina y el pronóstico. Sin embargo, no observamos diferencias en la complicación global. El sesgo de selección es difícil de eliminar en estos estudios porque cada paciente continuará siendo tratado de forma individualizada. Los pacientes con metástasis ósea tienen una esperanza de vida disminuida; por tanto, el análisis de la supervivencia puede no reflejar la longevidad del implante en todos los pacientes. El seguimiento de nuestros pacientes fue corto.
El estado de salud general preoperatorio es un parámetro importante en la predicción de la supervivencia en pacientes con metástasis esqueléticas aunque no todos los autores no informan sobre esto [12-18]. Steensma et al. [17] informaron un preoperatorio Eastern Cooperative Oncology Grupo (ECOG) con una puntuación de 2 puntos o menos, en el 88% de los pacientes tratados con enclavijado cefalomedular (ECM) en comparación con sólo el 61% en el grupo de la endoprotesis. En nuestro estudio la puntuación de ECOG de 2 puntos o menos fue del 89% en los pacientes tratados con ECM y prótesis. Nuestras puntuaciones MSTS del 57% y el 63% de lo normal en el enclavijado cefalomedular y en la endoprotesis respectivamente no muestra grandes diferencias comparado con las puntuaciones reportadas por Potter et al., [20] en pacientes con enfermedad metastásica en el fémur proximal tratados con EPR [21].
Las complicaciones que requieren reoperación son muy variables, del 3% al 26% [13][15]. Según Harvey et al., [16] la tasa es de 13,6% para los pacientes con enclavijado cefalomedular y 8,3% para el reemplazo endoprótesico en el tratamiento de la fractura patológica del fémur proximal [16], en cambio Johannes [15] obtuvo una tasa de complicaciones del 25% para ambos implantes.
En nuestra serie tuvimos 2 complicaciones, siendo ambas en el grupo con prótesis, una sepsis y una luxación recurrente la cual se resolvió mediante reducción cerrada. No obtuvimos complicaciones ni reoperaciones en el grupo de pacientes a los que se les practicó el enclavijado. Esto puede explicarse parcialmente ya que los paciente con un ECM tienen menor sobrevida en comparación a los que se les colocó un prótesis.
Won-Sik Choy et al., [3] en un estudio similar al realizado por nosotros tuvo una tasa de complicaciones del 16%, el grupo de las prótesis tuvo mayor tasa de complicaciones (22%) que el del ECM (10%). Harvey et al., [16] demostraron una tasa de complicaciones significativamente mayor para el enclavijado intramedular en las fracturas patológicas que en las fracturas inminentes.
Autores series mayores [13][16][17] abogan por la artroplastia a favor de la osteosíntesis en las metástasis del fémur proximal debido a su durabilidad superior y menor tasa de complicación.
En términos de supervivencia del paciente, es muy difícil estimar el papel del método quirúrgico o elección del implante a utilizar. Muchos cofactores han demostrado influir en la supervivencia del paciente en pacientes con enfermedad metastásica ósea como son la edad, el estado de salud general preoperatorio, el tipo de cáncer, la ubicación de la metástasis en el fémur o metástasis solitaria frente a múltiples [11-14]. Además, una fractura en comparación con la inminente fractura en los huesos largos parece ser otra causa esencial que influiría en la supervivencia del paciente [5][7].
Mavrogenis et al., [12] demostraron que las fracturas inminentes muestran mejor esperanza de vida, con tasas de supervivencia de aproximadamente el 60% al año, 40% a los dos años, 30% a los tres años y 20% a los 5 años. Las tasas de supervivencia en pacientes con fractura patológica femoral es del 45% a los seis meses, el 30% al año, el 15% a los dos años y menos del 10% a los 3 años [12][13][15]. Además, se ha señalado que el tipo de cirugía es un factor significativo en la supervivencia del paciente [12]. Esto también se demostró en las fracturas patológicas del fémur proximal donde se compararon 18 pacientes con prótesis y se realizó el enclavijado cefalomedular a otros 11 pacientes, con mayor sobrevida de los primeros [12]. Nosotros no encontramos diferencias significativas en la sobrevida de ambos tipos de implantes (p=0,423) y ninguno de los pacientes de nuestra serie murió debido a eventos embólicos intraoperatorios.
La elección debe ser individualizada para cada paciente y ambos implantes deben ser tenidos en cuenta y no oponerse a la hora de planificar el tratamiento a seguir.
Referencias
- Dijkstra PD, Oudkerk M, Wiggers T. Prediction of pathological subtrochanteric fractures due to metastatic lesions. Arch Orthop Trauma Surg. 1997; 116:221-4.
- Bickels J, Dadia S, Lidar Z. Surgical management of metastatic bone disease. J Bone Joint Surg (Am). 2009; 91-A:1503-16.
- Choy WS, Kim KJ, Lee SK, Yang DS, Jeung SW, Choi HG, Park HJ. Surgical treatment of pathological fractures occurring at the proximal femur. Yonsei Med J. 2015; 56:460-5.
- Mirels H. Metastatic disease in long bones: a proposed scoring system for diagnosing impending pathologic fractures. Clin Orthop Rel Res. 1983; 249:256–64.
- Harrington KD. The management of malignant pathologic fractures. Instr Course Lect. 1977; 26:147–62.
- Barrios E, Alonso R, Musetti C, Garau M. Situación epidemiológica del Uruguay en relación al cáncer. Registro Nacional del Cáncer CHLCC. Mayo 2014: 2-6.
- Barrios E, Garrau M, Alonso R, Musetti C. IV Atlas de incidencia de cáncer en el Uruguay: periodo 2007-2011:2-110.
- Rouviere H, Delmas A. Anatomia humana, descriptiva, topográfica y funcional. Barcelona, Masson SA, 11º ed, 2005, pp:331-3.
- Karnofsky DA, Burchenal JH. The clinical evaluation of chemotherapeutic agents in cancer. En: Evaluation of chemotherapeutic agents. CM MacLeod (ed). Columbia Univ Press; 1949:196.
- Ratasvuori M, Wedin R, Keller J, Nottrott M, Zaikova O, Bergh P, et al. Insight opinion to surgically treated metastatic bone disease: Scandinavian Sarcoma Group Skeletal Metastasis Registry report of 1195operated skeletal metastasis. Surg Oncol. 2013; 22:132-8.
- Enneking WF, Dunham W, Gebhardt MC, Malawer M, Pritchard DJ. A system for the functional evaluation of reconstructive procedures after surgical treatment of tumors of the musculoskeletal system. Clin Orthop Rel Res. 1993; 286:241-6.
- Mavrogenis AF, Pala E, Romagnoli C, Romantini M, Calabro T, Ruggieri P: Survival analysis of patients with femoral metastases. J Surg Oncol. 2012; 105:135-41.
- Wedin R, Bauer HC: Surgical treatment of skeletal metastatic lesions of the proximal femur: endoprosthesis or reconstruction nail? J Bone Joint Surg (Br). 2005; 87:1653-7.
- Takashi M, Takagi Y, Sakata T, Shimoji T, Miyake K. Surgical treatment of renal cell carcinoma metastasis: prognostic significance. Int Urol Nephrol. 1995; 27:1–8.
- Fakler JK, Hase F, Böhme J, Josten C. Safety aspects in surgical treatment of pathological fractures of the proximal femur modular Endoprosthetic replacement vs. intramedullary nailing. Patient Saf Surg. 2013; 7:37.
- Harvey N, Ahlmann ER, Allison DC, Wang L, Menendez LR. Endoprostheses last longer than intramedullary devices in proximal femur metastases. Clin Orthop Relat Res 2012: 470:684-91.
- Steensma M, Boland PJ, Morris CD, Athanasian E, Healey JH. Endoprosthetic treatment is more durable for pathologic proximal femur fractures. Clin Orthop Relat Res. 2012; 470:920-6.
- Tokuhashi Y, Matsuzaki H, Toriyama S, Kawano H, Ohsaka S: Scoring system for the preoperative evaluation of metastatic spine tumor prognosis. Spine. 1990; 15:1110-3.
- Katagiri H, Takahashi M, Wakai K, Sugiura H, Kataoka T, Nakanishi K. Prognostic factors and a scoring system for patients with skeletal metastasis. J Bone Joint Surg (Br) 2005; 87-B:698-703.
- Potter BK, Chow VE, Adams SC, Letson GD, Temple HT. Endoprosthetic proximal femur replacement: metastatic versus primary tumors. Surg Oncol. 2009; 18:343-9.